Sejarah Penemuan Reaksi Substitusi Nukleofilik
Tahun 1896,
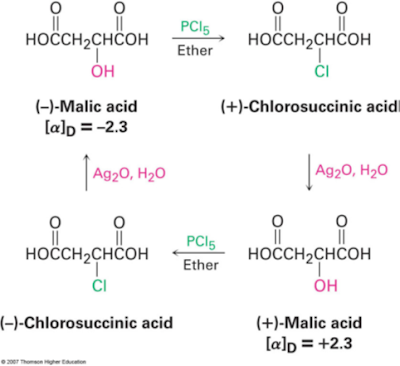
Walden melihat bahwa asam (-)-malat dapat dirubah menjadi asam (+)-malat
melalui tahapan reaksi kimia dengan pereaksi α-kiral. Penemuan ini yang
mengaitkan hubungan langsung putaran optik dengan kekiralan dan perubahannya
melalui alterasi kimia. Reaksi asam (-)-malat dengan PCl5 menghasilkan asam
(+)-klorosuksinat, Reaksi lebih lanjut dengan perak oksida dalam air
menghasilkan asam (+)-malat, Tahapan reaksi diawali dengan asam (+) malat
menghasilkan asam (-)-malat. berikut reaksi
inversi walden :
Signifikansi
inversi Walden
Reaksi alterasi terjadi pada pusat kiral dan
reaksi melibatkan substitusi pada pusat kiral. Jadi, substitusi nukleofilik
dapat menginversi konfigurasi pada pusat kiral, Adanya gugus karboksil pada
asam malat menimbulkan perdebatan mengenai sifat reaksi siklus Walden.
Reaksi Substitusi Nukleofilik
Reaksi substitusi merupakan reaksi yang melibatkan penggantian atom/gugus atom pada molekul
dengan atom/gugus atom lainnya. Reaksi substitusi umumnya terjadi pada senyawa
jenuh (tunggal) tanpa terjadi perubahan ikatan karakteristik (tetap jenuh)
A + B - C
--> A - C + B
Pada kimia organik maupun anorganik, merupakan
suatu kelompok dasar reaksi substitusi, dimana
sebuah nukleofil yang "kaya" elektron, secara selektif
berikatan dengan atau menyerang muatan positif dari sebuah gugus
kimia atau atom yang disebut gugus lepas (leaving group). Nukleofil sendiri sinonim dengan basa Lewis,
adalah suatu spesies netral atau anion yang mempunyai pasangan elektron bebas
yang berada dalam orbital molekuler berenergi tinggi. Reaksi nukleofil dapat
digolongkan menjadi reaksi nukleofi 1 (SN1), reaksi nukleofil 2 (SN2).
Bentuk umum reaksi ini adalah :
Nu + R-X → R-Nu + X
Dengan Nu menandakan nukleofil, menandakan
pasangan elektron, serta R-X menandakan substrat dengan gugus pergi X.
Pada reaksi tersebut, pasangan elektron dari nukleofil menyerang substrat
membentuk ikatan baru, sementara gugus pergi melepaskan diri bersama dengan
sepasang elektron. Produk utamanya adalah R-Nu. Nukleofil dapat
memiliki muatan listrik negatif ataupun netral, sedangkan substrat
biasanya netral atau bermuatan positif.
Contoh substitusi nukleofilik adalah hidrolisis alkil bromida, R-Br, pada kondisi basa, dimana nukleofilnya adalah OH− dan gugus perginya adalah Br-.
R-Br + OH− → R-OH + Br−
Reaksi substitusi nukleofilik sangat umum
dijumpai pada kimia organik, dan reaksi-reaksi ini dapat dikelompokkan sebagai
reaksi yang terjadi pada karbon alifatik, atau pada
karbon aromatikatau karbon tak jenuh lainnya
Mekanisme Substitusi Nukleofilik
Pada dasarnya terdapat 2 mekanisme substitusi
nukleofilik yaitu :
1. Reaksi nukleofil 2 (SN 2)
Nukleofil
menyerang dari belakang ikatan C-L.
Pada satu keadaan (keadaan peralihan) nukleofil dan gugus bebas keduanya
berasosiasi dengan karbon dimana substitusi terjadi. Pada saat gugus bebas
membawa serta elektronnya nukleofil memberikan pasangan elektron lain. Lambang
2 digunakan untuk mekanisme kerja ini sebab reaksi ini adalah bimolekuler atau dua molekul, yaitu
nukleofil dan substrat terlibat dalam 2 tahap kunci (memang hanya satu-satunya
tahap) dalam mekanisme reaksi.
Adapun cara mengetahui suatu nukleofil dan
substrat bereaksi dengan mekanisme SN2 yaitu :
1.
Karena nukleofil dan substrat terlibat, kecepatan reaksi bergantung pada
konsentrasi kedua pereaksi tersebut. Reaksi ion hidroksida dengan etil bromide
adalah salah satu contoh reaksi SN2. Jika konsentrasi basa (OH-)
dilipat duakan, kita dapati bahwa reaksi berjalan dua kali lebih cepat.Hasil
yang sama diperoleh jika konsentrasi etil bromide di lipatduakan. Akan kita
lihat segera bahwa sifat kecepatan reaksi begini tidak terdapat pada proses SN1.
2.
Reaksi terjadi dengan pembalikan(inverse) konfigurasi. misalnya, jika kita
mereaksikan (R)-2-bromobutana dengan natrium hidroksida, akan diperoleh
(S)-2-butanol. ion hidroksida harus menyerang dari belakang ikatan C-Br. Pada
saat substitusi terjadi, ke tiga gugus yang melekat pada karbon sp3
membalik. Jika OH menempati kedudukan yang samadengan Br, tentu (R)-2-butanol
yang akan diperoleh.
jika
substrat R-L bereaksi melalui mekanisme SN2, reaksi terjadi lebih
cepat apabila R merupakan gugus metil atau gugus primer, dan lambat jika R
adalah gugus tersier. Gugus R sekunder mempunyai kecepatan pertengahan. Alasan
untuk urutan reaktivitas jika kita menggambarkan mekanisme SN2. Di
bagian belakang karbon, tempat penggantian terjadi, keadaannya akan semakin
berdesakan apabila gugus alkil yang melekat pada karbon yang membawa gugus
pergi semakin banyak, sehingga reaksinya menjadi lambat.
2. Mekanisme SN1
Mekanisme SN1
adalah proses dua tahap. pada tahap pertama, ikatan antara karbon dan gugus
bebas putus, atau substrat terurai. electron – electron ikatan terlepas bersama
dengan gugus bebas, dan terbentuklah ion karbonium. pada tahap kedua, yaitu
tahap cepat, ion karbonium bergabung dengan nukleofil membentuk hasil.
Pada
mekanisme SN1 substitusi terjadi dua tahap. Lambang 1 digunakan
sebab pada tahap lambat hanya satu dari dua pereaksi yang terlibat, yaitu
substrat. tahap ini tidak melibatkan nukleofil sama sekali. dikatakan, bahwa
tahap pertama bersifat unimolekuler.
Adapun cara mengetahui suatu nukleofil dan
substrat bereaksi dengan mekanisme SN2 yaitu :
1.
Kecepatan reaksi tidak bergantung pada konsentrasi nukleofil. Tahap penentu
kecepatan adalah tahap pertama nukleofil tidak terlibat. Setelah tahap ini
terjadi, ion karbonium bereaksi dengan nukleofil.
2.
Jika karbon yang membawa gugus bebas bersifat kiral, reaksi mengakibatkan
hilangnya aktivitas optic (yaitu, rasemisasi). Pada ion karbonium, hanya ada
tiga gugus yang melekat pada karbon positif. Karena itu, karbon positif
mempunyai hibridisasi sp2 dan berbentuk datar.
3.
Jika substrat R-L bereaksi melalui mekanisme SN1, reaksi berlangsung
cepat jika R merupakan struktur tersier, dan lambat jika R adalah struktur
primer. Reaksi SN1 berlangsung melalui ion karbonium, sehingga
urutan kereaktifannya sama dengan urutan kemantapan ion karbonium. Reaksi
bergantung lebih cepat jika ion karbonium lebih mudah terbentuk.
Jadi,
reaksi substitusi nukleofilik terdiri dari dua jenis yaitu substitusi
nukleofilik bimolekuler (Sn-2) dan substitusi nukleofilik unimo-lekuler (Sn-1).
Reaktan yang lazim digunakan untuk reaksi substitusi nukleofilik adalah organo
halida karena ion halogen (X") adalah mempakan nukleofil yang sangat lemah
(gugus pergi) yang baik.
Reaksi SN1
Mekanisme SN1 dalah proses dua tahap
Pada tahap pertama, ikatan antarakarbon
dengan gugus pergi putus
Gugus pergi
terlepas dengan membawa pasangan elektron, dan terbentuklah ion karbonium. Pada
tahap kedua (tahap cepat), ion karbonium bergabung dengan nukleofil membentuk
produk
Pada
mekanisme SN1, substitusi terjadi dalam dua tahap. Notasi 1
digunakan sebab pada tahap lambat hanya satu dari dua pereaksi yang terlibat,
yaitu substrat. Tahap ini sama sekali tidak melibatkan nukleofil.
Berikut ini adalah ciri-ciri suatu reaksi
yang berjalan melalui mekanisme SN1:
1.
Kecapatan reaksinya tidak tergantung pada konsentrasi nukleofil. Tahap penentu
kecepatan reaksi adalah tahap pertama di mana nukleofil tidak terlibat.
2. Jika
karbon pembawa gugus pergi adalah bersifat kiral, reaksi menyebabkan hilangnya
aktivitas optik karena terjadi rasemik. Pada ion karbonium, hanya ada a gugus
yang terikat pada karbon positif. Karena itu, karbon positif mempunyai hibridisasi
sp2 dan berbentuk planar. Jadi nukleofil mempunyai dua arah penyerangan, yaitu
dari depan dan dari belakang. Dan kesempatan ini masing-masing mempunyai
peluang 50 %. Jadi hasilnya adalah rasemit. Misalnya, reaksi
(S)-3-bromo-3-metilheksana dengan air menghasilkan alkohol rasemik.
Spesies
antaranya (intermediate species) adalah ion karbonium dengan geometrik planar
sehingga air mempunyai peluang menyerang dari dua sisi (depan dan belakang)
dengan peluang yang sama menghasilkan adalah campuran rasemik X yang melalui
mekanisme SN1 akan berlangsung cepat-Reaksi
substrat R jika R merupakan struktur tersier, dan lambat jika R adalah struktur
primer. Hal ini sesuai dengan urutan kestabilan ion Karbonium, 3o > 2o
>> 1o.
|
SN2
|
SN1
|
|
|
Stuktur
Halida
Primer atau
CH3
sekunder
tersier
|
Terjadi
Kadang –
kadang
Tidak
|
Tidak
Kadang –
kadang
Terjadi
|
|
Stereokimia
|
Pembalikan
|
Rasemisasi
|
|
Nukleofil
|
Kecepatan
bergantung pada konsentrasi nukleofil, mekanisme memilih nukleofil anion
|
Kecepatan
tidak bergantung pada konsentarsi nukleofil, mekanisme memilih nukleofil
netral
|
|
Pelarut
|
Kecepatan
sedikit dipengaruhi kepolaran pelarut
|
Kecepatan
sangat dipengaruhi kepolaran pelarut
|
Berikut ini ada beberapa petunjuk yang digunakan
untuk mengetahui apakah suatu nukleofil adalah kuat atau lemah.
1.
Ion nukleofil bersifat nukleofil. Anion adalah pemberi elektron yang lebih baik
daripada molekul netralnya. Jadi :
2. Unsur yang berada pada periode bawah dalam tabel periodik cenderung
merupakan nukleofil yang lebih kuat daripada unsur yang berada dalam periode di
atasnya yang segolongan. Jadi :
3.
Pada periode yang sama, unsur yang lebih elektronegatif cenderung merupakan
nukleofil lebih lemah (karena ia lebih kuat memegang elektron). Jadi :
Karena C dan N N: ,ºberada
dalam periode yang sama, tidak mengherankan jika pada ion -:C yang bereaksi
adalah karbon, karena sifat nukleofilnya lebih kuat.
Permasalahan :
Pada reaksi SN1
terdapat istilah gugus pergi, sebernarnya apakah yang dimaksud dengan gugus
pergi itu dan mengapa pada
gugus pergi tergantung dari kuat atau lemahnya basa ?
Mohon bantuannya, Terima kasih






terimakasih syafira. saya akan mencoba menjawab pertanyaan anda yang pertama. Gugus pergi itu ialah gugus yang terlepas dari substrat dengan membawa pasangan elektron, dan terbentuklah ion karbonium.
BalasHapusterima kasih feni, balasan anda sangat membantu
HapusGugus pergi adalah gugus yang mudah putus apabila terjadi reaksi substitusi , dan kemudian di gantikan oleh gugus dari senyawa lain ( gugus tetangga).
BalasHapusSN 1 ditandai dengan reaksi yang melalui jalur karbokation. “gugus pergi “ pada reaksi SN1 haruslah terikat pada karbo tersier atau sekunder untuk menstabilkan zat intermediate nya. Dampak lain pada reaksi SN 1 memungkinkan terjadinya pergeseran hidrida dan metida.
Tergantung pada Kuat-lemahnya basa karena basa tidak terlibat dalam tahap penentu laju reaksi atau tidak memengaruhi pembentukan karbokation.
terima kasih ayu, komentarnya sangat bermanfaat
HapusGugus pergi adalah suatu basa yang lemah jika di bandingkan dengan nukleofil. Sedangkan nukleofil harus memiliki pasangan elektron bebas yg akan digunakan untuk berikatan dengan karbon menggantikan gugus pergi. Gugus pergi adalah substituen yang terlepas dari substrat, yang berarti atom atau gugus apa saja yang di geser dari ikatannya dengan atom karbon. Substrat ini bermuatan netral atau positif. Sedangkan nukleofil bermuatan netral atau negatif.Ion atau molekul yang merupakan basa yang sangat lemah. Seperti I-, Cr-, dan Br- merupakan gugus pergi yang baik. Karena mudah di lepaskan ikatannya dari atom C substrat. Sedangkan nukleofil yang baik adalah nukleofil yang bersifat basa kuat.
BalasHapusterima kasih yulia atas komentarnya
HapusBaik lah saya akan mencoba menjelaskan gugus pergi SN1/substitusi nukleofilik unimolekuler mudah dikenali karena memiliki dua tahapan reaksi. Tahap pertama merupakan tahap “perginya” (baca, putus/lepas) si gugus pergi dari suatu senyawa/molekul yang nantinya akan digantikan oleh gugus datang. Gugus yang pergi ini tidak sendiri, ia pergi dengan membawa pasangan elektron ikatan. Akibatnya senyawa/molekul yang ditinggalkan mengalami kekurangan elektron. Dengan kata lain senyawa mengalami ionisasi sehingga bermuatan positif dan memiliki hibridisasi sp3 berbentuk segitiga planar/datar. Senyawa yang telah bermuatan positif cenderung labil (mudah bereaksi) ketika berada dalam “mode” ini. Karena itu gugus datang akan dengan mudah masuk dan membentuk ikatan dengan suatu senyawa. Masuknya gugus datang dapat terjadi melalui dua arah yang berbeda, karnanya produk hasil reaksi SN1 akan berupa rasemat/campuran enantiomer/senyawa sama namun letak gugus datang dalam ruang 3D-nya berbeda.
BalasHapus